Teoría cinética y molecular de los gases
Propiedades de los gases
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
 Y cumplen con las siguientes.
Y cumplen con las siguientes.1. No tiene forma
Estos no tienen forma propia, y se adaptan al lugar donde esta contenido.
2. Fluidez
Propiedad de un gas, pues prácticamente sus moléculas no poseen unión entre ellas.
3. Difusión
Es cuando un gas se mezcla con solo con su movimiento.
4. Efusión
La rapidez con la que se transfiere de un lugar a otro por un orificio.
5. Compresión
Disminución de volumen debido a la presión ejercida a sus moléculas.
Teoría cinética de los gases
Teoría física y química, donde explica que por su composición los gases se mueven en linea recta.
considerando:
1. Un gas esta constituido por moléculas del mismo tamaño y masa para un mismo gas
2.Las moléculas se encuentran en constante movimiento
3. Sus fuerzas de atracción son despreciables.
4. El volumen de las moléculas es despreciable a comparación de su volumen como gas.
Para un mejor entendimiento de esto ve el vídeo de Gases Ideales
Ley de graham
Ley de Graham: enuncia que las velocidad de efusión y difusión son inversamente proporcionales a la raíz cuadrada de sus masas molares.

Los gases ideales es una simplificación de los gases reales que se realiza para estudiarlos de manera más sencilla. En sí es un gas hipotético que considera:
Ley de Boyle
Ley de Boyle: a temperatura constante, el volumen de un gas varia inversamente proporcional a la presión absoluta que recibe.
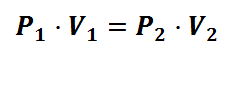
Ley de charles
Ley de charles: a presión constante el volumen varia inversamente proporcional a la temperatura absoluta.

Ley de gay-lussac
Ley de gay-lussac: a un volumen constante y para una masa determinada de un gas, la presión absoluta que recibe el gas es directamente proporcional a temperatura absoluta.
Ley de Dalton
Ley de Dalton: con una presión constante y una masa de un gas, el volumen del gas varia de manera directamente proporcional a su temperatura absoluta.

Ley general del estado gaseoso
Esta ley se consideran la combinación de leyes entre Ley de Boyle, Ley de Gay-Lussac y Ley de Charles. Pues estas hablan de la presión, volumen y temperatura.
Para esto se creo una formula general del estado gaseoso la cual es:

Gases reales
Un gas real, en oposición a un gas ideal o perfecto, es un gas que exhibe propiedades que no pueden ser explicadas enteramente utilizando la ley de gases ideales. Para entender esto se dice que a presiones cercanas a las ambientales actúan como ideales, pero a presiones muy bajas o muy altas sus propiedades se desvían en forma considerable.
Para mayor información ve el vídeo Gases Reales
Ecuación de Van Der Waals
En un gas ideal las moléculas se consideran masas puntuales que interaccionan entre sí mediante colisiones elásticas.
Van Der Waals introdujo correcciones que tenían en cuenta el volumen finito de las moléculas y las fuerzas atractivas que una molécula ejercía sobre otra a distancias muy cercanas entre ellas.
La ecuación de estado de un gas ideal es PV=nRT
P es la presión del gas, V es el volumen, T es la temperatura, n es el número de moles y R la constante de los gases.
Describe aproximadamente la conducta de los gases reales a muy bajas presiones.
La ecuación de van der Waals tiene en cuenta el volumen finito de las moléculas y las fuerzas atractivas que una molécula ejerce sobre otra a distancias muy cercanas entre ellas.



